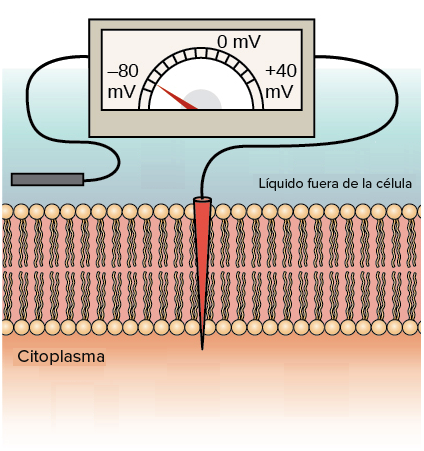
Es una rama de las ciencias biológicas que
estudia los fenómenos consistentes en la
producción de campos eléctricos producidos
por seres vivos.
Electrostática
Es el área de la física que se
encarga de estudiar
fenómenos asociados a
cargas eléctricas en reposo.
La electrostática es el punto
de partida para el estudio
del fenómeno de la
Electricidad.
Electrodinámica.
Parte de la física que
estudia las cargas
eléctricas en
movimiento y los
fenómenos que da
origen el movimiento
de las cargas eléctrica.
Carga
- Propiedades intrínseca
de electrones y
protones.
- Puede ser positiva o
negativa.
Diferencia de potencial.
- La diferencia de potencial entre A y B se relaciona con la
diferencia de energía asociada al movimiento de carga
entre los puntos A y B, bajo la influencia de un campo
eléctrico: Δ VAB = ΔE / q
- Cuando la energía asociada al desplazamiento de 1
Coulomb es de 1 Joule, la diferencia de potencial es 1
volt Volt = Joule/Coulomb
Ecuación de Nernst.
Se utiliza para calcular el potencial de
membrana, antes las variaciones en las
concentraciones de electrolíticos, como por
ejemplo: Diarreas, Vómitos, o cualquier
condición que lleve a deshidratación.
(concentración 1 M, presión de 1 atm,
temperaturas 298 K).
Equilibrio de Gibbs Donnan.
Es el equilibrio que se
produce entre los
iones que pueden
atravesar la membrana
y los que no son
capaces de hacerlo.
Corriente eléctrica.
Es el flujo de carga eléctrica por unidad de tiempo que recorre un material.
Conductancia (g).
- Permeabilidad del ion se expresa como
inversa a la resistencia.
- La unidad de conductancia es el siemens
(S).
Capacitor.
Estructura que puede almacenar cargas, el cual está
formado por dos láminas conductoras separadas por un
material aislante, ejemplo una membrana.
El cuerpo humano como resistencia
eléctrica.
El cuerpo humano actúa como una resistencia eléctrica, como la oposición al
paso de dicha corriente cuya unidad de medida es el Ohm y que además, en
caso de una descarga eléctrica, dicha corriente buscaría el menor camino de
resistencia en el cuerpo (tejido, piel, músculos, etcétera), teniéndose por lo
regular una salida en extremidades como son los brazos y pies, etc.
Potencial de membrana.
Es la diferencia de
potencial en ambos
lados de una membrana
que separa dos
soluciones de diferente
concentración de iones.El potencial,
por ende, estará
determinado
por el ion con
mayor
permeabilidad.
- Propiedades intrínseca de electrones y protones.
- Puede ser positiva o negativa.
Diferencia de potencial.
- La diferencia de potencial entre A y B se relaciona con la diferencia de energía asociada al movimiento de carga entre los puntos A y B, bajo la influencia de un campo eléctrico: Δ VAB = ΔE / q
- Cuando la energía asociada al desplazamiento de 1 Coulomb es de 1 Joule, la diferencia de potencial es 1 volt Volt = Joule/Coulomb
Ecuación de Nernst.
Se utiliza para calcular el potencial de
membrana, antes las variaciones en las
concentraciones de electrolíticos, como por
ejemplo: Diarreas, Vómitos, o cualquier
condición que lleve a deshidratación.
(concentración 1 M, presión de 1 atm,
temperaturas 298 K).
Equilibrio de Gibbs Donnan.
Es el equilibrio que se
produce entre los
iones que pueden
atravesar la membrana
y los que no son
capaces de hacerlo.
Corriente eléctrica.
Es el flujo de carga eléctrica por unidad de tiempo que recorre un material.
Conductancia (g).
- Permeabilidad del ion se expresa como inversa a la resistencia.
- La unidad de conductancia es el siemens (S).
Capacitor.
Estructura que puede almacenar cargas, el cual está
formado por dos láminas conductoras separadas por un
material aislante, ejemplo una membrana.
El cuerpo humano como resistencia eléctrica.
El cuerpo humano actúa como una resistencia eléctrica, como la oposición al
paso de dicha corriente cuya unidad de medida es el Ohm y que además, en
caso de una descarga eléctrica, dicha corriente buscaría el menor camino de
resistencia en el cuerpo (tejido, piel, músculos, etcétera), teniéndose por lo
regular una salida en extremidades como son los brazos y pies, etc.
Potencial de membrana.
Es la diferencia de
potencial en ambos
lados de una membrana
que separa dos
soluciones de diferente
concentración de iones.
El potencial,
por ende, estará
determinado
por el ion con
mayor
permeabilidad.